作者&圖片提供/財團法人宏恩綜合醫院肝膽胃腸科 譚健民
前言
非酒精性脂肪肝疾病(non-alcoholic fatty liver disease, NAFLD) 如今是全球最常見導致肝功能異常的原因。NAFLD本身包含著一系列的慢性肝疾病的病程,其中有屬於良性而可逆的脂肪性變性(simple steatosis),以及在多種觸發因素及壓力下,進展到嚴重病變的非酒精性脂肪肝炎(non-alcoholic steatohepatitis, NASH) ,其特徵在於肝細胞不僅已呈現脂肪變性、壞死以及炎症的病理變化,其最終亦會有可能衍生纖維化及肝硬化。
在臨床上,NAFLD盛行率與某些特殊風險因子有關,其中最重要的包括有遺傳易感性以及不適當的生活方式如營養過度或不良,以及個體運動量不足。事實上,在肥胖或代謝症候群的某些特徵中如胰島素阻抗及血脂異常,也與NAFLD衍生的因素有關。根據流行病學的研究探討,以年齡、性別、種族因素分類比較時,其中顯示 NAFLD盛行率為3~10%,但有趣的是倘若僅限於肥胖孩童及成年人口群中,其NAFLD盛行率可提高至20~80%之間。由最近的研究顯示,約有40%的NAFLD病人會進展為纖維化,而大於50%在4~13年內會進一步發展成NASH。因此,有效的臨床干預措施應即時給與NAFLD病人,以免其將來可能發展為NASH及肝細胞癌的併發症。
目前而言,NAFLD的真正致病機制仍不太清楚,但最為被廣泛接受的觀念除了遺傳因素之外,obesogenic (肥胖基因)食品的消費量增加,或許亦是導致NAFLD致病的重要原因之一,尤其是膳食中富含脂肪及果糖的攝取,亦會導致過量的脂肪生成,因其主要經過兩種途徑:一、衍生全身性胰島素阻抗增加,使得游離脂肪酸屯積在肝細胞內; 二、導致內臟脂肪屯積,再加上伴隨而來的胰島素阻抗,使得肝細胞發生脂肪變性。理論上,脂肪肝很容易受到再次的傷害,而使原有的脂肪變性程度更加劇烈,並促使NASH衍生,而NASH本身的激發因子亦包括有來自脂肪組織的脂肪細胞因子的產生與釋放的不平衡,再加上進一步引發細胞壞死的炎症反應、氧化應激、激活特定核受體以及纖維化不平衡的衍生。由於全身性胰島素阻抗刺激的增加,而促使胰島β細胞分泌過量的胰島素,也因而加速肝脂肪異常屯積在肝細胞內,因而導致NAFLD的衍生1。
雖然NAFLD本身的三酸甘油脂過度屯積的現象普遍存在於個體過重以及肥胖人口群中,但由動物實驗以及臨床經歷,亦顯示腸道菌群(gut microbiota)在NAFLD的致病機制中也扮演著極為重要的角色,其本身不僅可加強腸壁的完整性,並由此降低腸壁通透性,再加上阻止細菌移位(bacterial translocation)以及內毒血症(endotoxemia)的形成,並進一步減少氧化反應及肝細胞炎性反應的損傷,以達到提高NAFLD組織學狀態的改善。本文主要是將目前有關益生菌在NAFLD臨床治療上的新治療策略選擇,做一番文獻回顧性的探討2。
腸道菌群中的益生菌3
1907年,俄國學者Élie Metchnikoff首先在保加利亞居民中,發現在其所攝取的發酵牛乳中含有「乳酸菌」,並得知這種乳酸菌可以抑制消化道內的有害細菌,且與該居民普遍存有長壽的現象有關,而由此宣稱乳酸菌具有益於人類健康及促進壽命延長的功效。直到1965年才被 DM Lilly 與RH Stillwe二位學者提出「益生菌」(probiotics)的名稱4。
基本上,腸道菌群本身會形成一個複雜的微生態環境。人類胃腸道內存有約1014 CFU(colony-forming unit, 菌落形成單位)的細菌,重量約為1.3公斤,其數量亦超過人體細胞10倍,其中包括有大於104的細菌物種,而大部分尚未被培養出來,更有許多尚未被確認的。大部分細菌屬於厭氧性,不同部位的腸道其細菌數量及組合亦不一樣。菌數由胃臟開始存在,並逐步在空腸、迴腸及結腸中增加。腸道菌群本身的組合亦隨著年齡的增長以及飲食的不同而有所改變。理論上,腸道菌群已被証實在腸道免疫系統的形成中,發揮關鍵作用的角色,其亦可影響全身性免疫系統的功能。
腸道菌群包含有腸道內土生土長的細菌(autochthonous microbes)以及僅是短暫在腸道中移置的細菌(transient allochthonous),其中以雙歧桿菌、類桿菌以及消化道鏈球菌等專性厭氧菌(obligate anerobes)約佔腸道總菌量的99%,而大腸桿菌(Escherichia coli)、腸球菌(Enterococcus)、乳酸桿菌(Lactobacillus)等兼性厭氧菌約佔總菌量的1%;其中最主要的菌種包括有Bacteroides, Bifidobacterium, Clostridium, Enterococcus, Eubacterium, Fusobacterium, Peptostreptococcus, Ruminococcus, Lactobacillus以及 Escherichia,並由此構成複雜的腸道微生態環境(intestinal microenvironment),而致病菌與腐生菌共同存在於動平衡的多樣化環境中,其中益生菌相對的被認為是扮演著潛伏在其間,並以互相抵制的調節者自居。腸腔內最合適的酸鹼度在pH 5~6之間,而腸道菌群亦主要依賴短鏈脂肪酸(short-chain fatty acids, SCFA)以為生存的來源,抑制壞菌的腐敗發酵以減少腸氣產生,並促進個體免疫反應甚至具抗癌瘤衍生的激活作用。此外,大多數細菌在腸道中形成厭氧生物反應器(anaerobic bioreactor)中,有助於消化難以消化的多醣類,以及合成含有維生素如維他命B群(維他命B1、B2、B6、B12)、維他命K以及短鏈脂肪酸等微量營養素。這些細菌的發酵產物可以提供個體高達每日能量的10%。腸道微生物群落具有多種重要的生理功能,其可以產生維生素、分解膽汁酸以及消化營養物質,並可通過產生局部性及全身性免疫屏障的形成以對抗病原體(5)。
益生菌在最初的定義是指「某些微生物會協助其他微生物的生長」,後來又發現「在適量食用益生菌後,其會產生促進宿主健康的益處」。微生物必需要滿足某些條件才能被稱之為「益生菌」,其中包括有其來自於人體宿主本身,而必需不具致病性,具有高度抵抗性及耐受性而能存活在腸道內,並能夠附著在腸道黏膜上以為繁殖生長,同時具有阻擋其他致病微生物附著在腸道黏膜上的能力,以進一步促進人體的免疫系統的健全。因此,益生菌本身具有防止細菌易位以及黏膜上皮浸潤的功能,並且還可抑制其他壞菌的黏膜附著,並產生抗微生物肽(antimicrobial peptide)以減少腸壁炎症反應及刺激宿主免疫。近些年來,益生菌亦被建議作為用於預防及治療NAFLD所導致的慢性肝損傷的治療新選擇。
再者,根據國際衛生組織WHO及聯合國糧食農業組織FAO對益生菌的定義,指出益生菌是指具有活性的微生物,在臨床上適量的給與益生菌,可對宿主健康產生效應;因此,根據定義益生菌應符合以下數種條件如1、益生菌對胃酸及膽鹼必需具有耐受力。由於益生菌經由口服入胃及小腸而在到達大腸之前,會先受到胃酸及膽鹼的侵襲;換言之,益生菌對胃酸及膽鹽的耐受力,決定益生本身在體內的存活率。2、益生菌在腸道黏膜的附著力。益生菌在腸道黏膜的附著力,亦決定益生菌能否在腸道黏膜上成功定殖及繁殖生長。3、不同菌株的益生菌功效之差異。益生菌因菌株的種類不同,而對宿主具有不同的生理效應,因此益生菌在其製造過程中,亦應考慮其是否經過明確的科學實驗的證實,並具有促進身體健康的功效。4、多菌株的腸道菌群並不一定比單菌株好。益生菌產品的效果不是從菌株數目的多寡,來判定其優劣,不同的益生菌菌株,其功效亦不盡相同,也並非所含的菌株種類越多其效果越好,因此選定經由科學驗證有效的益生菌才是最重要的。因此,益生菌本身的安定性相當重要,較優等的益生菌基本上必需要具備有以上的基本條件,其中包括有在服用時為活生生的細菌、對人體無致病性、無毒性、耐酸、耐膽鹼、耐高溫熱而本身穩定性及安定性良好,對人體健康有所裨益更是重要的。然而,目前亦未有任何臨床指引明確指出益生菌服用的適當劑量,但一般臨床上建議的益生菌口服劑量為1010 CFU/天之間。
益生菌的腸-肝軸(gut-liver axis)作用機制6
最近有些研究報導,指出腸-肝軸在NAFLD本身多重相互複雜作用的網絡中,亦發揮其致病機制的重要關鍵。根據生理學的研究,肝臟及腸道中存在著所謂的肝-腸軸的密切關係,即腸道血液經由肝門脈系統供應含有激活肝臟功能的成份,而肝臟本身會分泌膽汁到腸管中來發揮其生理功能。在肝硬化病人中,存有小腸與大腸細菌定植異常的現象,而其中至少有50%個案比健康人存有小腸細菌過度生長(small intestinal bacterial overgrowth, SIBO)的現象,其主要原因被認為是低胃酸(hypochlorhydria),而導致IgA分泌的減少,並減少腸道蠕動,以進一步導致個體營養不良。因此,由於肝臟及腸道菌群間的這種緊密的關係,而得知腸屏障(gut barrier)在肝臟疾病及其併發症致病中扮演的某種重要的角色。由於腸屏障是病原體及食物過敏原進入腸道的第一道防禦,因此益生菌在腸屏障障礙的維護上更扮演著極為重要的角色。益生菌可以促進結腸上皮黏蛋白的分泌,並由此提升結腸自我保護腸道上皮完整性的功能。此外,益生菌亦可增強一種緊連接蛋白(tight junctional proteins, TJP)對上皮細胞層的物理密封性的功能,而免得其受到病原體的侵襲破壞。
基本上,腸黏膜本身具有固有的屏障防禦功能,以抑制主要由革蘭氏陰性細菌細胞壁所分泌的脂多醣(lipopolysaccharide, LPS)以及細菌內毒素的擴散進入體內循環中。NAFLD的衍生與腸滲透性的異常增加以及SIBO有關,而這些因素都與肝細胞脂肪變性的嚴重程度有密切關聯。在NAFLD病人中,由於腸壁的緊密連接發生中斷,而導致黏膜出現「洩漏」的現象,再加上腸道中的細菌及其產物經由腸-肝軸直接到達肝臟內,必然會進一步促使肝病變的衍生。由最近的一些研究證明,在導致孩童NAFLD的衍生中,其中腸道菌群的不一致的組成扮演極為重要的角色,而腸腔中增加單糖的吸收以及相關肝毒性產物,亦可導致低度慢性炎症反應的產生。
在某些情況下,由於腸屏障發生障礙,從而導致細菌及內毒素侵入胃腸道,而使得病原體侵襲至全身器官及組織,這個過程被稱之為「細菌移位」,會導致細菌由腸腔遷移至其他腸外部位的腸系膜淋巴結。最常見的細菌轉位到腸系膜淋巴結的細菌是腸桿菌科(Enterobacteriaceae)革蘭氏陰性成員如大腸桿菌、克雷伯菌屬(Klebsiella species)、腸球菌(enterococci)以及鏈球菌屬(streptococci species)。在動物實驗組研究中,腸系膜淋巴結細菌易位發生率在肝硬化腹水大鼠中約佔40%及自發性細菌性腹膜炎(spontaneous bacterial peritonitis, SBP)中約佔80%。總歸而言,導致細菌易位的主要機制是細菌過度生長、黏膜局部免疫反應缺陷、巨噬細胞及嗜中性粒細胞吞噬活性的減少以及腸屏障滲透性的增加7。
理論上,腸道菌群及其產物是導致肝毒性的重要來源。腸道菌群會受到飲食種類、生活方式、遺傳以及抗生素的使用等動態變數的影響而有所改變。腸道菌群本身會發揮其多種核心功能,其中包括有逃避膳食成分發酵的消化以及防範可能入侵病原體的攻擊。因此,腸壁屏障完整性的維持,對於個體擁有一個健康的腸-肝軸的作用環境是很重要的。事實上,由於細菌與宿主及其他腸道菌群的定性及定量的改變,會使得腸內環境的穩定性發生不平衡現象,並進一步導致腸滲透性的紊亂。
由研究指出,細菌易位及其所衍生的促炎分子及細胞因子代謝所產生的紊亂現象,再加上腸道菌群中SIBO的現象,可以改變許多慢性肝臟疾病的病程。可想而知,NAFLD病人本身存有腸滲透性增加以及SIBO障礙的兩大異象,亦即顯示NAFLD可以受到不同腸道菌群作用的影響而有所變化,而腸道菌群能夠直接影響腸管內容物熱量的回收,而導致個體在肥胖發生前的體重增加;此外,腸道菌群及其相關內毒血症亦可通過各種不同的致病機制,在NAFLD致病中參與胰島素阻抗的發生。此外,腸道黏膜完整性的改變,亦可以經由其通透性的增加,而導致細菌易位以及細菌產物進入循環中,而進一步促使NAFLD的衍生。
在正常情況下,內毒血症會迅速被肝臟網狀內皮系統所清除,但腸道菌群組成及數量的改變會影響宿主的能量代謝、免疫反應以及炎症反應。NAFLD本身常伴隨有SIBO的現象,以及某些菌群種類及數量的改變,由此使得腸道黏膜通透性異常的增加。此外,腸道菌群會通過增強肝臟的脂肪合成,並誘導胰島素阻抗以及啟動相關免疫系統分子模式的啟動機制,而進一步誘發肝臟炎症反應的啟動,甚至肝纖維化的進展;因此,腸道菌群本身的修飾可以用來預防及治療NAFLD。
腸道菌群的NAFLD分子致病機制探討8,9
在幾個動物模型實驗組中,其結果已顯示益生菌可以抑制脂肪肝的進展。在ob/ob小鼠腸道菌群的一項動物實驗研究中,給與餵食含有三種類型益生菌(鏈球菌、雙歧桿菌及乳桿菌) 的混合益生菌VSL#3共4週,顯示其在肝總脂肪酸含量以及肝細胞炎症反應有減少的現象,並且肝胰島素阻抗亦有改進。另一項研究表明,通過使用益生菌治療,來下調NF-κB的活性,可以直接減少前炎症細胞因子。在一個以VSL#3補充物餵食高脂肪飲食所衍生的NAFLD動物模型實驗中,與對照組比較時,發現其可以減少脂質過氧化標誌物如TNF-α、iNOS(inducible nitric oxide synthase, iNOS)及環氧合酶2(cyclooxygenase 2)的指數。
基本上,益生菌在NAFLD致病機制上,只要是通過產生抗微生物因子如短鏈脂肪酸(short chain fatty acids, SCFAs)的作用,來排除或抑制入侵細菌對肝臟衍生NAFLD的影響。此外,益生菌產生有益健康的副產品如SCFAs具有降低腸道pH(大腸道內ph值介5.5~6.8之間)的功效,不僅製造有利益生菌存活的腸道環境,更由此抑制革蘭氏陰性細菌的生長。此外,益生菌可以修補腸道上皮黏膜的通透性及其完整性固有的功能,並且能夠通過刺激緊連接蛋白黏蛋白的生成,以提升非特異性腸道屏障的防禦功能,並由此降低SIBO及細菌易位的不利影響;另一方面,腸道益生菌亦會降低內毒血症。一旦革蘭氏陰性細菌在死亡後,其中的LPS會被釋放到腸道並滲透到微細血管中,更經由toll樣受體4(TLRS4)作用進而激起TNF-α的分泌;因此,益生菌會進而抑制炎症。腸道炎症導致增加的黏膜滲透性及細菌易位,其中某些細胞因子如TNF-α會增加腸道滲透性,並經由改變緊密連接的形態及其分佈,來呈現一個持續性惡性循環狀態。某些研究亦指出益生菌的抗炎作用,會通過抑制IL-8的分泌,來顯現其抗炎作用,IL-8本身是一種強效的嗜中性粒細胞活化趨化因子(neutrophil-activating chemokine),其亦主要是經由某些病原細菌,來刺激腸上皮細胞而釋放出來的,IL-8本身亦是由NF-κB的轉錄調控的。
基本上,益生菌好處的機制尚未十分完全瞭解,其四大益處包括有:(1)抑制致病菌的侵入,以避免其在腸腔中生長繁殖以及與上皮細胞結合;(2)改善腸屏障功能;(3)調節免疫系統各種功能,其中包括有誘導保護性細胞因子(protective cytokines )如白介素-10(Interleukin-10, IL-10)及轉化生長因子-β(transforming growth factor β, TGF-β)、抑制促炎細胞因子如腫瘤壞死因子(tumor necrosis factors)以及抑制T輔助1細胞( T-Helper 1)的遷移;(4)通過誘導微阿片類(micro opioid) 及大麻素受體(cannabinoid)的表達,來調節腸痛覺感受器的功能。
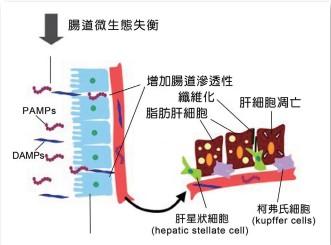
圖1 腸道微生態失衡(dysbiosisi)產生的衍生物對肝細胞衍生NAFLD過程的影響10。
平常膳食中攝取過多富含脂肪及果糖的食物亦可能會擾亂腸屏障,並增加腸源性產品對腸道的滲透性,其中PAMPs(pathogen-associated molecular patterns)與DAMPs(damage associated molecular pattern)會被釋放進入全身循環,而PAMPs與DAMPs進入肝細胞內,並首先促進脂肪囤積在肝細胞,其次導致肝細胞損傷,甚至肝纖維化。
理論上,腸-肝軸的存在是使得潛在細菌的肝毒性產物如LPS很容易經由腸-肝軸途徑到達肝臟。這些細菌性化合物通常可以歸類為病原體相關分子模式(pathogen-associated molecular patterns, PAMPs)以及損傷相關分子模式(damage associated molecular pattern, DAMPs),這些細菌性化合物在導致NASH壞死性炎症及肝損傷途徑中則扮演著上調的功能,並經由信號傳導級聯 (signaling cascade)的方式,來觸發特異性免疫受體的作用,以及活化促炎細胞因子基因(proinflammatory cytokine genes)如腫瘤壞死因子-α及白介素的表現,由此再進一步加劇肝細胞損傷的惡化。
腸道菌群一旦成功定殖在腸道中,則已建立好一個既有的動態生存模式,而可經由幾個途徑產生不同的炎性反應,來導致NAFLD進一步的進展下去。雖然何種腸道菌群對於人類健康有益與否,目前倘無法十分明確評估,但由近些年來越來越多的宿主動物模型試驗的研究,証實某些代謝紊亂疾病的控制,可以因腸道益生菌菌群的存在而得以改善。
眾所周知,NAFLD的進展亦取決於遺傳及環境因素,後者包括通過腸壁的細菌易位及SIBO現象。在動物實驗研究證據中,顯示SIBO在NAFLD的致病機制中扮演著重要的角色。在肥胖病人接受空腸迴腸旁路手術(jejunoileal bypass surgery)後,細菌過度生長亦會加速NAFLD的惡化,其中內毒血症則通過刺激肝臟Kupffer cell來產生TNF-α,並進一步激發NAFLD肝纖維化的惡化。腸道菌群產物如脂多醣是革蘭氏陰性細菌細胞壁的成份,會通過肝門靜脈轉送到肝臟內。腸道菌群所生產的內毒素可導致肥胖、糖尿病、代謝症候群、NAFLD甚至NASH的炎症反應。在NAFLD的小鼠模型研究試驗中,細菌過度生長可引起腸道菌群組成的變化,並通過減少緊密連接蛋白的表達來增加腸黏膜的通透性。在大多數飲食誘導的NAFLD及NASH的動物模型試驗中,會有內毒素濃度升高的現象。此外,血漿內毒素濃度顯著與NAFLD病人的病理組織嚴重性、SIBO及腸黏膜通透性增加有關。因此,NAFLD的複雜致病機制廣泛涉及脂質屯積、炎症反應、氧化應激以及胰島素阻抗的參與,並因而導致肝細胞毒性的作用,以及進一步加劇原有肝病的嚴重性。因此,益生菌的服用可以修飾腸道菌群,而進一步阻止NAFLD的進展。
理論上,益生菌會改變腸道菌群,從而抑制脂多醣的產生。由於益生菌與結腸黏膜表層蛋白質的相互競爭,就可排除黏膜表面的微生物,而其中緊密結合蛋白(zonula occludens-1, ZO-1occludens-1)則保持不變,並由此防止微生物易位至腸系膜淋巴結,而不易到達肝臟。此外,通過信號轉導級聯反應的進行,益生菌本身可以促進抗炎細胞因子的分泌,其中包括有白介素-10及轉化生長因子β,並由免疫細胞的T調節細胞來主導。益生菌的先天免疫反應包括有杯狀細胞所增加黏蛋白,及具有保護修復腸道黏膜功能的小腸三葉因子(intestinal trefoil factor, TIF)生產,並由潘氏細胞(Paneth cell)及腸上皮細胞主導腸黏膜的抗菌防禦作用。
基本上,免疫系統具有一系列特定的模式識別受體(pattern recognition receptors, PRRs)如TLRs,是一種屬於保守進化的I型跨膜糖蛋白(transmembrane glycoproteins);該TLRs屬於PAMPs或DAMPs免疫感受器,可引發信號級聯並導致促炎性基因活化,而每一個TLRs有選擇性特定的PAMPs 或DAMPs。在肝臟中,TLRs表達為許多不同細胞類型如Kupffer細胞以及肝星狀細胞(hepatic stellate cells, HSC),以作為TLRs對細菌內毒素脂多醣特異性的受體,也是促炎性細胞因子的關鍵誘導物如TNF-α、IL-6、IL-8以及IL-12等等,以活化肝臟中的過轉錄激活因子如核因子κB (nuclear factor kappa B, NF-kB) 、激活蛋白 (activating protein 1, AP-1) 以及LPS誘導TNF-α (LPS-induced TNF-α factor, LITAF)。
此外,胰島素阻抗在NAFLD及NASH的致病機制中亦扮演著極為重要的關鍵角色11。肝胰島素阻抗可以促進肝細胞損傷及炎症反應。腸道菌群及其腸源性內毒血症會參與胰島素阻抗的進行,特別是通過LPS-TLRS4-單核細胞分化抗原CD14系統。此外,抑制或修正SIBO現象,可以減少致炎細胞因子的產生、降低空腹胰島素濃度以及胰島素阻抗。由糖尿病大鼠實驗模型中,發現益生菌的給與,可以經由胰島素非依賴的機制來降低血糖的濃度。再者,在慢性肝損傷過程中,由於不斷的重複對肝細胞的損害,而進一步激活HSC纖維化的進展,而肝門靜脈中的腸道菌群及毒血症的存在亦復如此,其不僅激活Kupffer細胞以及誘導TGF-β的生產,更隨後激活HSC。
益生菌在NAFLD治療上的臨床使用成效
目前來說,NAFLD的治療仍然存在不少的爭議。益生菌可以控制腸道菌群,並調節腸道中微生物的生長,同時眾多研究結果亦顯示其可以促進肝功能的恢復。隨著越來越多的證據表明,某些有益的腸道菌群有助於 NAFLD的抑制,而益生菌亦已被考慮用於NAFLD病人的治療。在NAFLD動物模型研究中,亦指出益生菌會降低肝組織炎症反應的活動,並改善腸道上皮屏障的完整性。
腸道菌群的比例依賴飲食的種類而異,但存在於肥胖個體或小鼠中的的門類擬桿菌(phyla Bacteroid)與厚壁菌門( Firmicutes)中的90%以上的腸道菌群,在人體前10~20歲時就已被改變了。
Kalliomäki等人12由實驗得知在正常體重的孩童與其將來會衍生肥胖的孩童人口群中,其腸道菌群中的雙歧桿菌屬(Bifidobacterium bifidum)與糞便金黃色葡萄球菌(Faeces staphyloccocus aureus)存在著不同比率的分佈,由此可以預期在將來歲月中可能會會有肥胖的發生。
Vreugdenhil等人13亦認為脂肪的消耗可以產生多種脂蛋白乳糜微粒(lipoprotein- containing chylomicrons),其可以引導LPS在肝臟的移位。
Spencer等人14在人類無膽鹼飲食研究中,指出γ-變形菌/厭氧產芽胞菌 Erysipelotrichi的平衡關係,亦可以關乎到脂肪肝的發生。
Cani15等人在一個小鼠飼與高脂飲食的實驗模型中,給與雙歧桿菌(Bifidobacterium),發現其代謝障礙得以改善,同時炎性細胞因子亦為之減少;反之,細胞因子增加與LPS的給與量成正比,而由此發現腸道菌群的改變與飲食成份息息相關,並指出高脂飲食的攝取會增加LPS的濃度,表示其釋放LPS亦會抑制直腸真桿菌(Eubacterium rectale)、梭狀芽孢桿菌(Clostridium coccoides)以及雙歧桿菌(Bifidobacterium)的繁殖。
在各種不同的試驗研究中,許多益生菌都曾被測試其是否其可以藉由改變腸道菌群比例,來恢復微生態環境平衡,而其中尤以乳桿(Lactobacillus)及雙歧桿菌(Bifidobacterium)是最常被用以研究評估的益生菌,而發現其可以調整某些代謝性功能紊亂疾病如血脂異常,用以降低LDL-C及VLDL-C及降低三酸甘油脂,但不同的菌群則有不同的效應。
由各種實驗研究及臨床試驗結果中,顯示在改善NAFLD病變的益生菌效果基礎上,適當飲食以及運動本身就可以改善單純性脂肪肝病變。但在過去的NAFLD治療藥物中,亦要配合生活方式的改變,再結合對特定觸發因子的多靶點治療方法,可能會比單一治療方法來得好,尤其對孩童的NAFLD病變更為有效。目前而言,在各種考驗的藥物療法中16,除了胰島素增敏劑(insulin-sensitizers)、抗氧化劑(antioxidants)以及肝細胞保護劑(cytoprotective agents),也已發展出另一個針對NAFLD致病機制主要因素治療的嘗試,而腸道菌群的修飾可能是一個有效而多靶向治療的目標之一。此研究已由幾個動物模型研究中,顯示腸道菌群中的益生菌有減少腸道炎症以及改善上皮屏障功能存在。
此外, Loguercio等人17在幾種類型的慢性肝疾病包括NAFLD接受長期益生菌VSL#3(VSL#3是一種具有八種益生菌菌株的組合,其中包有Lactobacillus casei, L. plantarum, L. acidophilus, L. bulgaricus, B. longum, Bifidobacterium breve, B. infantis, 及Streptococcus thermophilus)治療中,得知益生菌可減少肝細胞損傷及促炎細胞因子( proinflammatory cytokin),以及改善肝轉氨的異常。
在Vajro等人18的研究中,也指出20個存有肝轉氨酶異常的肥胖孩童脂肪肝病人,在其接受益生菌(Lactobacillus Rhamnosus strain GG, 12 billion CFU/day)治療後8個星期,被發現有肝轉氨酶及抗肽多醣抗體(antipeptidoglycan-polysaccharide antibodies)降低結果的出現。
在一個更大的研究計劃中,益生菌及低聚果糖(fructooligosaccharide)在NAFLD生活方式的變化,與益生菌介入治療後,其有顯著降低TNF-α、CRP、AST、胰島素阻抗、血清內毒素、脂肪變性以及NASH activity指數的結果。在臨床上,長期使用益生菌可以改善脂肪肝病變及其血清肝轉氨酶的恢復。由最近的統合分析(meta-analysis)結論中,亦得知益生菌可以改善NAFLD病人的肝轉氨酶、總膽固醇、TNF-α以及胰島素阻抗19。
再者,在某個丁酸梭菌(Clostridium butyricum)的益生菌動物實驗中20指出,丁酸梭菌可以預防NAFLD的進展。丁酸梭本身即為製造丁酸(butyric acid)的革蘭氏陽性厭氧菌,其可發現在土壤及動物與人類的腸道中。梭狀芽胞桿菌miyairi 588菌株的丁酸梭菌被做為益生菌,以治療及預防非抗細菌性腹瀉、抗生素相關性腹瀉以及便祕的治療。丁酸是一種短鏈脂肪酸,可由微生物在大腸及迴腸遠端中,所存在的抗性澱粉或難以消化的多醣發酵後所生產出來的短鏈脂肪酸。由臨床試驗顯示,丁酸經由腸腔內灌輸後,可成功的治療潰瘍性結腸炎及其相關炎症性腸疾病。富含丁酸飲食補充物會誘導的腺苷5'-單磷酸活化蛋白激酶激活(AMPK),從而預防及治療高脂飲食所誘導的肥胖及胰島素阻抗的小鼠。AMPK可調節能量平衡,通過其對葡萄糖及脂質代謝的影響,通過調節線粒體生物合成控制脂肪酸氧化,並且通過減少的轉錄因子固醇調節元件結合蛋白1c(sterol regulatory element binding protein-1c, SREBP-1c)的活性抑制生脂基因的表達。AMPK也降低肝脂肪生成,AMPK的活性可以抑制反應性的反應性氧化物(reactive oxidative species, ROS) 以及炎症反應。由體外實驗表明,丁酸鈉(sodium butyrate, NaB) 的治療可以提升AMPK活性以及加速在結腸上皮細胞的緊密連接蛋白的完整組裝。
由以上研究可知,益生菌中的梭狀芽胞桿菌miyairi 588經由腸-肝軸以及活化系統性信號傳導途徑的機制,來防止NAFLD的進展。梭狀芽胞桿菌miyairi 588亦開啟了AMPK的活化,並調節不同的病理生理事件如脂質及能量代謝、胰島素敏感性以及氧化應激反應(oxidative stress response),再加上緊密連接蛋白的修飾,由此抑制NAFLD的進展。
此外,Yadav H等人也證明增加腸道菌群丁酸能增強表達GLP-1的活性。GLP-1早已被稱為是由小腸與近端結腸的腸嗜鉻細胞(enterochromaffin cells)分泌的腸促胰島素(incretin),當食物攝取後,GLP-1由這些細胞釋放出來,並刺激胰腺β細胞,從而促進胰島素的敏感性,並因此有助於葡萄糖與脂肪的代謝作用。
結語與未來展望
雖然益生菌耐受性良好,即使在肝硬化病人也可使用,但這也不是說益生菌沒有任何風險的,尤其是重症疾病病人,或那些免疫功能低下者,在臨床上亦有發現急性重症胰臟炎病人給與益生菌治療,其死亡率風險增加的報告。
總之,由臨床研究觀察顯示,腸道菌群在NAFLD進展的潛力,由此亦可得知腸道菌群的益生菌效應,是一種具有前景的治療劑,並可因而恢復NAFLD及NASH相關的肝細胞損傷現象。理論上,健康微生物群的改變僅是複雜腸-肝軸相互作用的一部份,而微生態環境失調(dysbiosis)是導致代謝與胃腸道功能紊亂的原因之一。近世紀以來,已有許多的研究嘗試找出細菌、病毒、真核生物中與宿主的反向關係,而探討其與宿主的免疫系統通信的關係,並由此了解宿主-微生物與眾多疾病間的相互關係,以期試圖找出新的尖端治療策略。
近些年來,在臨床上的試驗已有較大的樣本量及長期的追蹤成果。相信在不久的將來,再加上環境的污染,NAFLD的盛行率將會快速的上升;因此,尋找安全及適當的治療模式是必要的,而益生菌可被認為是有前途的NAFLD的療法之一。在幾篇研究綜述中,亦支持益生菌在治療NAFLD及NASH中可能扮演著重要的角色;雖然,參與試驗者人數有限,但由研究顯示益生菌可減少脂質過氧化的兩個重要標誌物如4-羥基壬烯酸(4-hydroxy azelaic acid, HNE)、丙二醛(malondialdehyde, MDA)與炎症細胞因子如TNF-α的濃度。
益生菌的補充亦可影響血脂的降低。其致病機制可以通過益生菌的發酵產物來抑制膽固醇合成酶的作用,從而降低膽固醇的產生。因此,由以上研究結果,亦顯示有希望利用益生菌來作為治療NAFLD方法。此外,更要注意益生菌的各種不同菌株、服用期間,益生菌與伴隨益生元的相互關係,益生菌在給藥後其在腸道中存活的時間,因為以上眾多因素的任何變化,亦可能影響使用益生菌的效果。益生菌在NAFLD的治療是很有希望的,但目前來說尚需要更多的臨床使用實證,以及更多的試驗樣本與長時間的追蹤監測,以評估益生菌的所有可能效果及其副作用。
總之,以上這些令人鼓舞的結果,雖然強烈表明在使用益生菌治療NAFLD上有很大的成效,但要達到實証醫學的cochrane meta-analysis條件,仍需要更大更多的隨機雙盲的臨床研究19。
參考文獻
1.Brunt EM: Pathology of nonalcoholic fatty liver disease. Nat Rev Gastroenterol Hepatol 2010; 7: 195–203.
2.譚健民:非酒精性脂肪肝疾病的現代觀:著重於其衍生「肝纖維化」的致病機轉之探討,台灣醫界,2008;51:274-279.
3. Cani PD, Delzenne NM: The role of the gut microbiota in energy metabolism and metabolic disease. Curr Pharm Des 2009; 15: 1546–1458.
4. Clemente JC, Ursell LK, Parfrey LW, et al.: The impact of the gut microbiota on human health: an integrative view. Cell 2012; 148: 1258–1270.
5. Eslamparast T, Eghtesad S, Hekmatdoost A, et al.: Probiotics and Nonalcoholic fatty liver disease. Middle East J Dig Dis 2013; 5: 129-136.
6. Compare D, Coccoli P, Rocco A, et al.: Gut–liver axis: the impact of gut microbiota on non alcoholic fatty liver disease. Nut Metab Cardiovasc Di 2012: 22: 471–476.
7. De Gottardi A, McCoy KD: Evaluation of the gut barrier to intestinal bacteria in non-alcoholic fatty liver disease. J Hepatol 2011; 55: 1391–1399.
8. Iacono A, Raso GM, Canani RB, et al.: Probiotics as an emerging therapeutic strategy to treat NAFLD: focus on molecular and biochemical mechanisms. J Nutr Biochem 2011; 22: 699–711.
9. Malaguarnera M, Di Rosa M, Nicoletti F, et al.: Molecular mechanisms involved in NAFLD progression. J Mol Med 2009: 87: 679–695.
10.Alisi A, Carsetti R, Nobili V: Pathogen- or damage-associated molecular patterns during nonalcoholic fatty liver disease development. Hepatology 2011; 54: 1500–1502.
11. Tilg H. Moschen AR: Insulin resistance, inflammation, and non-alcoholic fatty liver disease. Trends Endocrinol Metab 2008; 19: 371–379.
12. Kalliomäki M, Collado MC, Salminen S, et al.: Early differences in fecal microbiota composition in children may predict overweight. Am J Clin Nutr 2008; 87: 534–538.
13.Vreugdenhil AC, Rousseau CH, Hartung T, et al.: Lipopolysaccharide (LPS)-binding protein mediates LPS detoxification by chylomicrons. J Immunol 2003; 170: 1399–1405.
14. Spencer MD, Hamp TJ, Reid RW, et al.: Association between composition of the human gastrointestinal microbiome and development of fatty liver with choline deficiency. Gastroenterology 2011; 140: 976–986.
15.Cani PD, Neyrinck AM, Fava F, et al.: Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through amechanism associated with endotoxaemia. Diabetologia 2007; 50: 2374–2383.
16.譚健民:胰島素增敏劑治療非酒精性脂肪性肝病之實證醫學分析,台灣醫界,2010;331-337.
17.Loguercio C, Federico A, Tuccillo C, et al.: Beneficial effects of a probiotic VSL#3 on parameters of liver dysfunction in chronic liver diseases. J Clin Gastroenterol 2005: 39L: 540–543.
18.Vajro P, Mandato C, Licenziati MR, et al.: Effects of Lactobacillus rhamnosus strain GG in pediatric obesity-related liver disease. J Pediatr Gastroenterol Nutr 2011; 52: 740–743.
19. Ma YY, Li L, Yu CH, et al.: Effects of probiotics on nonalcoholic fatty liver disease: a meta-analysis. World J Gastroenterol. 2013; 19: 6911-6918.
20. Endo H, Niioka M, Kobayashi N, et al.: Butyrate-producing probiotics reduce nonalcoholic fatty liver disease progression in rats: new insight into the probiotics for the gut-liver axis. PLoS One 2013; 16; (5):e63388. doi: 10.1371/journal.pone.0063388.