文、圖/宏恩綜合醫院肝膽胃腸科 譚健民、宏恩綜合醫院神經內科 黃增文
前言
激躁性腸道症候群(irritable bowel syndrome, IBS)是臨床上常見的一種胃腸道功能紊亂性疾病,主要以腹部不適、排便習慣改變、糞便型狀異常為主要特徵,其症狀及表徵則會持續存在或間歇發作。在臨床上,激躁性腸道症候群大致上可以分為腹瀉型、便祕型、腹瀉與便祕交替型以及僅是腹痛型。根據流行病學的研究顯示,全球有10~20%的成人及青少年有激躁性腸道症候群症狀,女性稍多於男性,男女性比在1∶1~2之間1,2。
基本上,激躁性腸道症候群是一種以腹部不適及排便習慣改變為特徵的常見功能紊亂性胃腸道疾病,目前其病因及致病機制尚不太完全明確;但因其在臨床上缺乏「形態學」以及「生物化學」的客觀性異常指標的評定,再加上其本身致病機制的多樣化及複雜性,因此目前在臨床上尚未能有一個很明確而充分認定的結論。激躁性腸道症候群最常涉及的致病因素包括有精神因素、遺傳因素、腸道感染後、腸道菌群生態失衡(gut microbial dysbiosis)、腸道黏膜屏障礙、腸道荷爾蒙分泌異常的腦-腸軸 (brain-gut axis)失調與胃腸動力異常,再加上由中樞神經、周圍神經及腸神經系統所導致的內臟超敏反應(visceral hypersensitivity)現象,因此激躁性腸道症候群病人比一般人口群有更多常見的消化不良、呼吸急促、全身酸痛、焦慮、憂鬱以及失眠的多樣化症狀與表徵3。
基本上,造成激躁性腸道症候群的病因仍然不明。有鑑於此,激躁性腸道症候群是用一些症狀組合來診斷,目前常用為羅馬準則(Rome IV Criteria, 2016),但是這些症狀的背後可能至少包含了數種致病機轉,其中包括有一、腸道蠕動功能障礙:部分病人的腸道蠕動緩慢,部分則較快,另有一部分病人為快慢交替出現;二、感覺異常:由許多研究發現,當在直腸或乙狀結腸中置入氣球打氣時,激躁性腸道症候群病人會比一般人在較小的打氣量或氧壓下,即產生不適感甚至嚴重腹痛,其所以導致腸道過度敏感的現象,主要可能是由於臟器接受器敏感度的改變、脊髓神經刺激的增強、中樞感覺神經調節機制的異常等等所致;目前則著重於訊息交流異常研究,其中被稱之為腸腦(gut-brain)的腸間神經系統(enteric nervous system, ENS)最為受到重視。由於腸間神經叢位於腸壁內,其大部份的神經傳導物質不受中樞神經系統影響而獨立運作,而進一步由此調節腸道肌肉的收縮,並可傳遞腸道訊息至自主及中樞神經系統中,並再進一步接受其所下傳的神經傳遞指令。雖然,目前醫學家認為內臟敏感性增高是導致激躁性腸道症候群較具有意義的病理生理機制之一,但激躁性腸道症候群本身的內臟高敏感性確切的神經生物學機制尚不太很清楚,多數的研究亦指出腦-腸軸上存有多種機制單獨或共同作用,來導致內臟感覺異常現象。因此,本文就近年來有關激躁性腸道症候群病人的腸道局部機械性受體、神經末梢超敏感性、神經通路與腸神經系統的互相協調以及益生菌促進內臟敏感性增高的相互關係做一文獻上的綜述及其探討4,5。
胃腸道的傳入與傳出神經通路4
在胃腸道運動的調控中,神經系統扮演著極為重要的角色,其主要經由三個層次相互協調。第一層次是由腸道神經叢內肌源性的自律性活動對其運動及分泌進行局部調控;第二層次是調控位於椎前神經節,其中含有周圍交感神經的節後神經元,主要支配整個胃腸道器官,並接受來自腸道神經叢及中樞神經系統兩方面的訊息;第三層次的調控在中樞神經系統,主要接收腦部各級中樞及脊髓接受體內外環境變化時傳入的各種訊息;經過整合後,經由自主神經系統及神經內分泌系統,將其調控訊息傳送到胃腸道的腸神經叢或直接作用到平滑肌,由此進一步調整整個胃腸道蠕動及分泌功能。
由內臟感受器所傳入衝動而產生的感覺稱之為「內臟感覺」,內臟感受器在感受體內環境變化後,會按其刺激性質的不同而可分為化學性、機械性、溫覺性、痛覺性等多種類型的表現。內臟感覺神經纖維主要分佈在交感神經及副交感神經中,傳入衝動則沿著這些神經從背根進入脊髓,或沿腦神經進入腦幹,並引起各種相對應的反射作用。內臟傳入衝動還可以進一步經下視丘上行至大腦皮層及邊緣系統(limbic system),再通過下視丘相關的神經元來調節各式各樣的內臟活動。
基本上,消化道同一部位的感覺可由多個部位神經元所調控,而一個神經節又可參與消化道多個部位神經的調控。在臨床上,所謂「內臟高敏感性」是指內臟組織對各種內在或外在環境因素的刺激感受性增強的現象,在一般研究上其主要是經由各種感覺所導致的腹痛容量閾值(abdominal pain volume thresholds, APVT)及腹痛壓力閾值(abdominal pain pressure thresholds, APPT)的變化,來進行對內臟敏感性變異客觀的評估,其中最常被應用的就是直腸擴張試驗(rectal distention test, RDT)6,7,8。
腸神經系統與內臟高敏感性的相互關係9,10
由神經生理學的研究中,得知其「內臟高敏感性」主要受制於周圍神經及中樞神經的調控。胃腸道主要受腸神經系統(enteric nervous system, ENS)、迷走神經(vagal afferents)、脊髓神經(spinal afferents)、交感神經(sympathetic efferents)及副交感神經(parasympathetic efferents)的控制。
基本上,腸神經系統由肌間神經叢及黏膜下神經叢所組成,內含感覺神經元、中間神經元及運動神經元,按一定規律組成局部反射迴路,主要是支配及調節消化道的胃腸各種功能性的活動。1921年,英國Langley將自主神經系統分為交感神經系統、副交感神經系統及腸神經系統。
由神經生理學的研究證明,ENS在胃腸壁內存有一個完整的神經反射網絡構造,其中包括有位在背根神經節內的一級感覺神經元(primary sensory neurons)、中間神經元(interneurons)以及支配胃腸效應器的運動神經元。基本上,ENS獨立於中樞神經系統的大腦之外,並非是一個神經系統的中繼站(relay station ),而是一個獨立並具有獨特調節胃腸道運動、分泌、吸收以及血液循環等功能的獨立神經系統,但仍屬於自主神經系統的一個組成部分,故又稱之為腸腦。
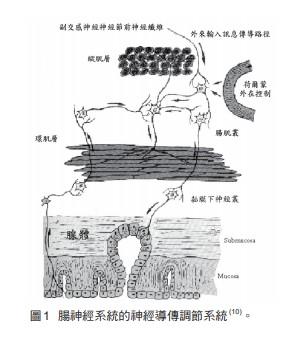
腸神經系統是由存在於胃腸壁內神經節及其神經纖維所組成,在胃腸道壁中形成不同層次的神經叢,位於胃腸縱行肌(longitudinal muscle)及環行肌(circular muscle)間的神經叢為肌間神經叢(myenteric plexus),位於環行肌及黏膜層下的黏膜下神經叢(submucous plexus),又稱之為麥氏神經叢(Meisser's plexus),其位於腸系膜及腸肌層外面稀疏的漿膜下神經叢(subserous plexus),位於胃黏膜層的黏膜神經叢(mucosal plexus)以及環行肌層的厚外層與薄內層間的深肌神經叢;而神經叢由神經節細胞及無數神經纖維所組成,包括傳入壁內的外來神經纖維及內在纖維,共同將神經節細胞聯系在一起,組成一個完整的調節系統(圖1)。此外,即使肌間神經叢主要是控制肌肉收縮,而黏膜下神經叢則主要是控制分泌,而其間的關聯是十分密切的9。
在ENS中,內在初級感覺神經元(intrinsic primary afferent neurons, IPANs)主要參與內在感覺的調節,而內臟感覺的上傳,亦會通過外在初級感覺神經元(extrinsic primary afferent neurons, EPANs)來傳遞。IPANs對低閾值的非傷害性刺激即可產生反應,並激發腸神經反射,但這種反應比較弱,有時不會向上傳導;然而IPANs亦可對傷害性刺激產生反應,此亦是做為保護胃腸道反應的機制之一。一旦當胃腸道內環境發生改變時,IPANs的功能可被調適為可產生較為強烈的感覺訊息,並能向上傳導,使得個體產生相對應的不適感。由研究實驗得知,激躁性腸道症候群病人對機械性刺激較具有高敏感性,由此顯示腸壁存有引發高敏感性的初級反應機械性受體,在臨床上則可經由檢測直腸本身的壓力,來作為診斷激躁性腸道症候群的參考依據及指標11,12。
腸神經系統的神經傳遞物質
目前在腸神經系統中已被發現的神經傳遞物質包括有5-羥色胺(5-hydroxytryptamine, 5-HT)、三磷酸腺苷(adenosine triphosphate, ATP)以及多種神經肽如血管活性腸肽(vasoactive intestinal peptide, VIP)、P物質(substance P, SP)、生長抑素(somatostatin)、蛙皮素(bombesin)、腦啡肽(enkephalin)、膽囊收縮素(cholecystokinin, CCK)、胰多肽(pancreatic polypeptide, PP)及神經降壓素(neurotensin, NT)等等4,13,14。
在如此眾多的神經傳遞物質中,被研究最多的是5-HT,其主要是由5-HT神經元(5-hydroxytryptamine neurons)所釋放出的神經傳遞物質,該神經元在肌間神經叢中發出的神經突起(neurite)有的進入黏膜下神經叢。5-HT主要作用於平滑肌及神經節,並作用於膽鹼神經元(cholinergic neuron)而引起胃腸道縱行肌及環行肌的興奮。
激躁性腸道症候群與腸神經系統神經傳遞物質的相互關係
基本上,激躁性腸道症候群病人本身的自主神經系統中的交感神經活動亦較一般人為強,相對來說副交感神經活動則較弱,自主神經系統可促使肥大細胞(mast cell)釋放活性物質如5-HT及組織胺(histamine),導致內臟感覺閾值下降;此外,可經由ENS引起平滑肌緊張度的改變,使腸壁壓力與容積比的順應性發生改變,並由此導致內臟傳入纖維的傳入衝動增加。此外,胃腸黏膜本身亦可感受內臟機械性及化學性刺激,並由此分泌感覺神經傳遞物質(如5-HT),由此傳遞物質來調節胃腸道蠕動、分泌以及協調胃腸道感知的功能,其在腦-腸軸上亦扮演著重要的神經介質的角色。由分子醫學的研究亦證實,激躁性腸道症候群病人本身的腸蠕動反應過強、感覺閾值降低以及心理或精神異常的臨床表現,與血清5-HT的升高有不等程度的關係。此外,由生理學研究亦得知5-HT作用於不同的受體則會有不同的表現,其中與激躁性腸道症候群致病機制最為密切的5-HT受體是5-HT3受體及5-HT4受體13。
臨床上,腹瀉型激躁性腸道症候群(diarrhea-IBS, D-IBS)與便祕型激躁性腸道症候群(constipation-IBS, C-IBS)病人有著完全不一樣的腸道蠕動形式,可能與個體內各種5-HT受體相互不協調,以及受體分佈比例不同有關。雖然,5-HT主要來自於肥大細胞的分泌,但腸道腸嗜鉻細胞(enterochromaffin cell, EC)亦是製造及儲存5-HT的場所,而激躁性腸道症候群病人本身結腸黏膜內的肥大細胞及腸嗜鉻細胞明顯亦較一般人增高,因而導致血清中5-HT濃度的增加。
由近年來的研究,亦發現在激躁性腸道症候群病人血清中,除了5-HT分泌增高之外,其他胃腸激素亦發生某些程度的變化,其中包括有P物質及降鈣素基因相關肽(calcitonin gene-related peptide, CGRP),其等對肥大細胞的活化具有反向調節作用,而VIP及一氧化氮(nitric oxide)則對肥大細胞的活化具有正向調節作用。
此外,根據分子醫學的研究,亦發現D-IBS的結腸黏膜中P物質含量明顯升高,由於P物質陽性的神經末梢與肥大細胞緊密相鄰,P物質與平滑肌上神經肽2(tachykinin neurokinin 2, NK2)受體結合後,可啟動膽鹼性神經元及5-HT神經元,甚至促使肥大細胞分泌組織胺,進而增加結腸推進運動的強度,不僅使得排便次數增加,並因而導致腹瀉的症狀,同時P物質還可刺激黏膜下分泌神經元,促進腸黏膜水份及電解質的分泌。
因此,P物質及NK2受體在激躁性腸道症候群腸道內臟高敏感性致病的機制中,著實扮演極為重要的角色,由此機制而發展出一種具有tachykinin NK2受體拮抗作用的標靶藥物(如otilonium bromide, Catilon®)
激躁性腸道症候群的益生菌之腦-腸軸理論
激躁性腸道症候群是一種功能性的腸道疾病,其特徵在於通過排便而能緩解腹部疼痛或不適感,並伴隨著排便習慣的改變如腹瀉或便祕交替出現的改變,其不能完全以個體在結構上、生化上或代謝異常上來解釋其作用機制。由上文已知激躁性腸道症候群的病理生理學與內臟超敏反應、腸通透性的改變、遺傳或環境因素、心理因素或腦-腸軸的失調有關。雖然,已知內臟超敏反應對激躁性腸道症候群症狀的作用機制有著重要的作用,但有些臨床醫學家則認為內臟超敏反應異常增加僅僅是反映個體不等程度的心理反應如焦慮或憂鬱。而內臟超敏反應似乎是只是區分激躁性腸道症候群與功能性腹痛症候群(functional abdominal pain syndrome)的重要指標,但由研究中顯示激躁性腸道症候群對生理性擴張有較低的敏感度,儘管激躁性腸道症候群與功能性腹痛症候群具有相類似的臨床特徵。Posserud等人由109例的激躁性腸道症候群病人的直腸感覺與胃腸道及其心理症狀間的關係中,亦顯示直腸感覺的改變在激躁性腸道症候群病人中是很常見,並且與胃腸道症狀的嚴重程度(特別是腹痛與腹脹)有著密切的關係。在激躁性腸道症候群病人中,直腸本身的順應性與疼痛閾值會下降,對直腸球囊擴張的超敏反應則佔33%,並且與其症狀的嚴重性有關。
由於益生菌的治療機制擁有對腸微生物動態平衡的調節、干擾病原體定植、感染黏膜的能力、調節局部及全身性免疫反應以及穩定或維持胃腸道保護屏障功能的功效;因此,近些年來有為數不少的臨床醫師認為腸道菌群本身的生態環境失調,亦會導致體內多種生理功能障礙,如腦-腸軸的互相衝突對立、神經內分泌系統的失調以及免疫系統的失衡,而由此衍生一連串的激躁性腸道症候群的出現,使得益生菌在激躁性腸道症候群的診治上也扮演著一種極為微妙的角色。
在以往眾多益生菌對激躁性腸道症候群輔助治療的研究上,也得知益生菌的服用有著不等程度的效應,但其最主要的還是取決於所服用益生本身的所屬類型、服用的時刻、給與的途徑、最適宜的劑量、服用益生菌的喘息時間以及選擇哪類亞型的激躁性腸道症候群病患,因此不同的硏究設計也呈現不同程度的效應。近些年來,在益生菌給與的研究中,與以前用以評估益生菌對激躁性腸道症候群症狀的影響,已經有了一個不一樣的結果。在最近的研究中,顯示使用益生菌4周治療,可以改善激躁性腸道症候群症狀與改變其中腸道菌群的組合,並且在激躁性腸道症候群病人中的益生菌治療將類桿菌屬(genus Bacteroides)減少到如健康對照組的組合,並且改善激躁性腸道症候群症狀。事實上,近年來在Cochrane Library中,已有多篇統合分析(meta-analysis)的研究,已証實益生菌對激躁性腸道症候群病患的治療的確有著不等程度的效應16,17。
此外,亦要考慮個體由口服途徑來攝取益生菌時,其中益生菌難免會遇到胃酸及小腸膽鹽酸的侵襲與破壞,因此益生菌要如何避開高胃酸的時段是很重要的。根據臨床醫學試驗結果,顯示口服益生菌不論其是以發酵乳型態存在或是特殊單獨醫療型菌株口服的攝取,其最終能存活在盲腸(大腸啓端)的存活機會約在20~40%之間不等。如此,經由胃大腸內視鏡灌注的途徑,在個體益生菌的給與方式中,扮演著舉足輕重的角色。2011年,學者Tompkins等人在其所研究的各類種益生菌中,在不同進食時段服用情況下,比較各類益生菌在大腸黏膜上黏附度以及存活率的狀況,結果顯示益生菌在隨餐服用、餐間服用或是飯後小於30分鐘內立即服用,才是最佳的時機。近些年來,臨床胃腸科醫師將益生菌直接經由大腸纖維內視鏡的檢查過程中,灌注到某個特定部位的大腸管腔,並使其即時移植在大腸黏膜上的一種臨床治療方式,已成為目前臨床作業上益生菌給與的必要考慮的輔助療法(圖2)18,19,20。由此步驟可以避免益生菌因經由口服方式途徑,而受到胃臟內強酸以及小腸內鹼性膽鹽及胰液消化液的破壞,而無法達成全數移植到大腸黏膜上的目的。

激躁性腸道症候群的治療
基本上,激躁性腸道症候群本身並不一定就需要服用藥物治療來治療,其最主要的治療方針還是遵守「健康飲食」的規範,即避免攝取會加重本身症狀的食物以及迴避生活壓力的影響;其中富含纖維類食物可能對便祕型激躁性腸道症候群有效,因纖維可以改善及促進腸道的蠕動功能;此外,激躁性腸道症候群病人在飲食方面更需要避免生冷食物。一旦衍生腹痛症狀時,可以服用抗膽鹼藥(anticholinergic drugs)如atropine、propantheline bromide或scopolamine butylbromide類藥物,但應注意這些抗膽鹼藥所會帶來的不良副作用;此外,亦可使用某些較具有特異性的腸道平滑肌鈣離子通道拮抗劑(calcium channel antagonists)如otilonium bromide。
腹瀉可選用loperamide(藉由與腸壁opiate接受體的接合,來阻止乙醯膽鹼及前列腺素的釋放,進而緩和腹瀉) 及diphenoxylate(一種中樞神經抑制劑) 。便祕可使用作用溫和的輕瀉藥,以減少不良反應及藥物依賴性,其中包括如容積形成藥如psyllium preparation或methyl cellulose;滲透性輕瀉劑如polyethylene glycol、lactulose、lactitol(一種糖醇)或sorbitol。在臨床上,有些臨床醫師使用5-HT4 partial receptor agonist如tegaserod maleate來改善便祕型激躁性腸道症候群病人的便祕、腹痛及腹脹的症狀。對存有嚴重性腹痛症狀而對上述藥物治療無效時,特別是伴隨較明顯精神症狀的病人可以嘗試使用抗抑鬱藥藥物,或者考慮給與心理治療、認知治療、催眠療法以及生物回饋療法1,18 。
結語及未來展望
基本上,激躁性腸道症候群是一種常見的現代消化系症候群,其主要是指一群呈現腹痛、腹脹、排便習慣及糞便型狀異常,症狀持續存在或間歇發作,但缺乏形態學及生化異常變化來做為解釋的症候群。在臨床實務上,則需須經過一系列的檢查,以排除可能引起相類似症狀的器質性疾病,方可給與激躁性腸道症候群的這個診斷。
事實上,由近些年來的研究報告,亦顯示激躁性腸道症候群的致病機制主要是導源於胃腸動力學的異常,而其中又受內臟感覺異常及神經傳遞物質的影響。理論上,激躁性腸道症候群的致病因素很多,其中常見的包括有精神因素、生活壓力、職場工作壓力以及不良生活習性等;而症狀發作或加重均與情緒緊張,焦慮憂鬱、激動及恐懼等情緒不穩定的因素有關,而由此進一步影響植物神經功能,從而引起結腸及小腸運動功能改變以及其腸道分泌功能的失調。約有四分之一激躁性腸道症候群病人的症狀併發自原先的胃腸炎、痢疾或其他直接影響胃腸功能的疾病。因此,亦有研究認為細菌或病毒感染因素可能亦會引起腸黏膜下肥大細胞或者其他炎性細胞所釋放的細胞因子的作用,進而引起腸道功能紊亂,而導致進一步激躁性腸道症候群的衍生。
根據流行病學的探討,激躁性腸道症候群具有明顯的家族集聚傾向。由國外調查研究亦顯示,約有三分之一病人有家族史,而且同一家族中相互間臨床表現亦雷同。此外,激躁性腸道症候群病人可因乳糖酶缺乏發生乳糖類消化不良的病症,而有為數不少的病人可會在進食刺激性食物而發作,此可能對某種或多種食物耐受不良,致使腸腔擴張及腸蠕動正常功能發生紊亂而致病。因此,病人一旦出現腹痛、噁心、嘔吐、腹脹、腹瀉、便祕、裡急後重及排便困難等症狀時,首先要到醫院檢查,先排除是否存有某些感染性疾病或腫瘤等器質性病變1,19,20,但千萬不要自行服用成藥,以免因而掩蓋某些致命的潛在疾病。
附註:激躁性腸道症候群的大腸內灌注益生菌(intracolonic instillation of probiotics)輔助治療的實況影片說明18,19,20。
參考文獻
1.El-Salhy M, Hatlebakk JG, Gilja OH, et al.: Irritable bowel syndrome: recent developments in diagnosis, pathophysiology, and treatment. Expert Rev Gastroenterol Hepatol 2014; 8: 435–443.
2.Ibrahim NK: A systematic review of the prevalence and risk factors of irritable bowel syndrome among medical students. Turk J Gastroenterol 2016; 27: 10-6.
3.El-Salhy M: Irritable bowel syndrome: diagnosis and pathogenesis: World J Gastroenterol 2012; 18: 5151–563.
4.Gershon MD: Nerves, reflexes, and the enteric nervous system: pathogenesis of the irritable bowel syndrome. J Clin Gastroenterol 2005; 39: S184-S193.
5.林明賢,連漢仲,葉宏仁等:胃腸動力學之最新進展,內科學誌,2015;26:143-149。
6.Defilippi GC, Quera PR, Madrid SAM, et al.: Rectal barostat in irritable bowel syndrome. Rev Med Chil 2006; 134: 1524-1529.
7.Lee YJ, Park KS: Irritable bowel syndrome: emerging paradigm in pathophysiology. World J Gastroenterol 2014; 20: 2456–2469.
8.Munakata J, Naliboff B, Harraf F, et al.: Repetitive sigmoid stimulation induces rectal hyperalgesia in patients with irritable bowel syndrome. Gastroenterology 1997; 112: 55-56
9.Gebhart GF: Pathobiology of visceral pain: molecular mechanisms and therapeutic implications IV. Visceral afferent contributions to the pathobiology of visceral pain. Am J Physiol Gastrointest Liver Physiol 2000; 278: G834-G838.
10.Deiteren A, de Wit A, van der Linden L, et al.: Irritable bowel syndrome and visceral hypersensitivity : risk factors and pathophysiological mechanisms. Acta Gastroenterol Belg 2016; 79: 29-38.
11.Heitkemper M, Burr RL, Jarrett M, et al.: Evidence for autonomic nervous system imbalance in women with irritable bowel syndrome. Dig Dis Sci 1998; 43: 2093-2098.
12.Ritchie J: Pain from distension of the pelvic colon by inflating a balloon in the irritable colon syndrome. Gut 1973; 14: 125-132.
13.Moskwa A, Boznańska P: Role of serotonin in the pathophysiology of the irritable bowel syndrome. Wiad Lek 2007; 60: 371-376.
14.Palsson OS, Morteau O, Bozymski EM, et al.: Elevated vasoactive intestinal peptide concentrations in patients with irritable bowel syndrome. Dig Dis Sci 2004; 49: 1236-1243.
15.Moffet D, Moffet S, Schauf C, (eds). Human Physiology, Foundations & Frontiers, St Louis, Mosby-Year Book, 1993: 592-651.
16.Yuan F, Ni H, Asche CV, al.: Efficacy of Bifidobacterium infantis 35624 in patients with irritable bowel syndrome: a meta-analysis. Curr Med Res Opin 2017:1-17.
17.Mozaffari S1, Nikfar S1, et al.: Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World J Gastroenterol 2015;21:3072-3084.
18.譚健民:益生菌在消化系統疾病診治上所扮演角色的今日觀,台北市醫師公會會刊,2016;60:31-40.
19.譚健民:非酒精性脂肪肝疾病致病機制的探討:著重於腸道菌群所扮演的角色,台灣醫界,2016;60:31-40.
20.譚健民:益生菌在臨床診治上所扮演角色的現代觀:著重於一種大腸内益生菌灌注的新興療法之探討,永信藥訊電子版,2016年7月號.
http://www.ysp.com.tw/ysp/Product-Medicine-01.aspx?tc=6b&volumn=201607&sn=5, accessed 2016/12/15